診療科のご案内消化器科
消化器科
診療活動

当院消化器内科では食道・胃・十二指腸・大腸の消化管や肝臓・胆嚢・胆管・膵臓など、消化器疾患全般を対象として診断と治療を行います。
早期癌の診断・発見のため、2023年度から春日部市胃がん検診に参加し、また当院独自の胃がんドックも開始しています。なるべく苦痛のない内視鏡検査を目指し、経鼻内視鏡やご希望があれば鎮静化での検査も施行しています。担当する内視鏡医はほぼ内視鏡専門医もしくは指導医を取得しており、また内視鏡技師や看護師と連携し、安全で精度の高い検査を行っています。大腸内視鏡検査は午後だけではなく、午前中や土曜日も施行しており、予約枠も比較的多いため、ご希望の日時で検査が可能です。
治療については、食道、胃、早期大腸癌に対する内視鏡的粘膜下層剥離術(ESD)を積極的に行い、従来では治療困難であった病変でも最新の器具および技術により病変を一括して切除することが可能になりました。
当科では胆嚢、胆管、膵臓疾患が多く、内視鏡的逆行性胆管膵管造影(ERCP)を用いた治療を行っています。重症胆嚢炎に対する内視鏡的胆嚢ドレナージ治療(ENGBD)、胆管結石に対する内視鏡的胆道砕石術、腫瘍による閉塞性黄疸に対する内視鏡的胆管ステント留置術など速やかに施行しています。
膵臓については早期膵臓がんの発見を目指し、外来検査結果でがんが疑われる方に対してERCPを用い膵管にチューブを留置して行う連続膵液細胞診検査(SPACE)を施行しています。また重症膵炎に対する超音波内視鏡を用いたドレナージ術も行っています。
肝臓については当地域は依然としてB型肝炎、C型肝炎が多く、肝炎採血検査を推奨し、直接作用型抗ウイルス剤(DAA)などを用いた治療を積極的に導入しています。
近年、潰瘍性大腸炎やクローン病といった炎症性疾患(IBD)が増加傾向にあり、若年者だけではなく中高年者にも増えてきています。現在様々な治療薬が開発され以前と比較して、良好にコントロールができるようになりました。当科ではほぼすべての治療薬が投与可能ですが、それでも改善しないような重症例では、ハイボリュームセンターと連携して高度な治療を行っています。
消化器癌に対しては、腫瘍内科の医師と連携しながら、最新の知見をもとに、外来化学療法を行っています。その際には化学療法専門の看護師や薬剤師とも連携し患者さんに寄り添った治療を心がけています。消化管通過障害などの症状が出現した場合には内視鏡を用いた内視鏡ステント留置術を行い、症状の改善に努めています。
他にも消化器全般の疾患に対応していますので、お困りの症状があれば気軽にご相談ください。
内視鏡的粘膜下層剥離術(ESD)
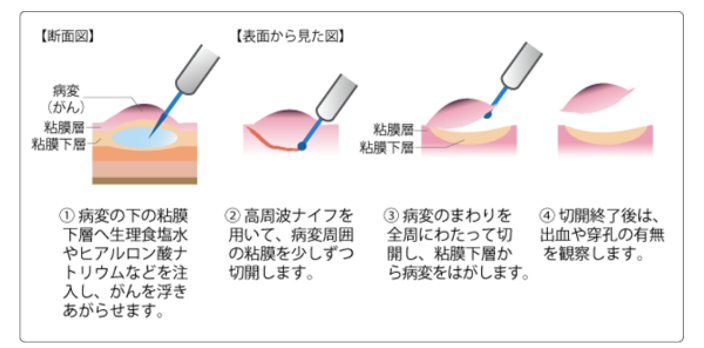
内視鏡手技・検査器具の進歩により、食道、胃、大腸の早期の癌に対して、ESDによる治療が行われるようになりました。ESDは、がんの下の粘膜下層にヒアルロン酸ナトリウムなど局注液を注入して、がんを浮き上がらせ、がんの周りの粘膜を高周波ナイフで切開し、粘膜下層から病変をはぎ取る方法です。
早期胃癌については2006年、早期食道癌については2008年、早期大腸癌については2011年より保険収載され、通常の保険診療で行うことができます。当院では、早期食道癌、早期胃癌、早期大腸癌、いずれについてもESDによる治療が可能です。当院ではESDによる入院期間は約1週間程度です。
ESDによる治療の利点は、病変部位や大きさに関わらず、一括で切除することが可能であるため、従来までの内視鏡治療よりも根治性が高いこと、および切除標本を正確に評価することが可能であり、切除後の病理結果に応じて、追加治療の必要性について検討することが可能である点です。切除標本の病理結果が最終診断になるため、結果によっては追加治療が必要になる場合もあります。
早期食道癌のESD
食道癌の治療方法は内視鏡治療のほかに、外科手術、放射線治療、抗がん剤治療などがあります。中でもリンパ節に転移している可能性の極めて低い早期食道癌に対しては、胸は開かずに内視鏡で粘膜病変部を切除するESDが用いられます。ESDは外科手術と比較し、胸に傷がつかず、食道の機能が保たれるうえ、入院日数も短期間で退院できます。
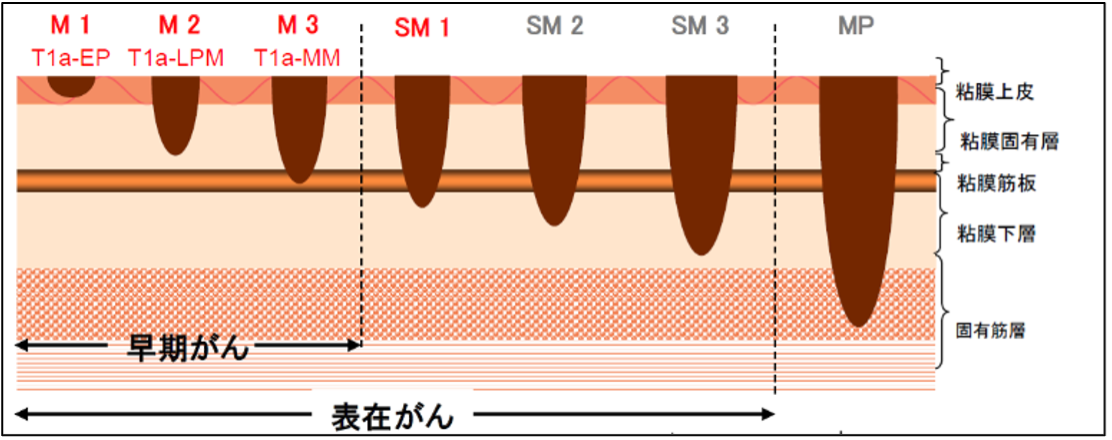
日本消化器内視鏡学会の食道ESD・EMRガイドラインでは以下のように絶対的治療適応と相対的治療適応が定められています。

早期胃癌のESD
胃癌に対するESDの対象は、ほぼ粘膜内にとどまっていると診断された早期胃癌です。
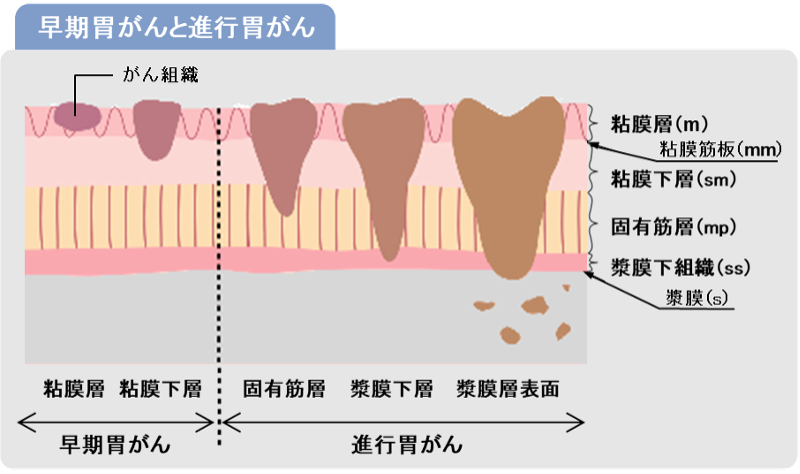
日本消化器内視鏡学会の治療ガイドラインでは、「病変が一括でとれる部位と大きさであること」、「リンパ節転移の可能性がほとんどないこと」がESDの基本要件とされており、具体的には以下の条件を満たすものが対象になります。

当院で施行した早期胃癌ESD症例(治療時間 約60分、偶発症なし)
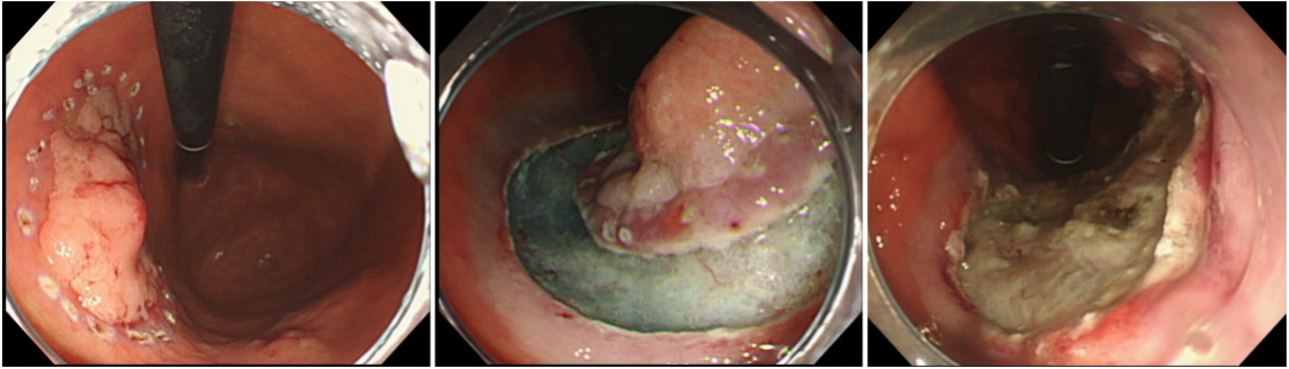
病理結果)
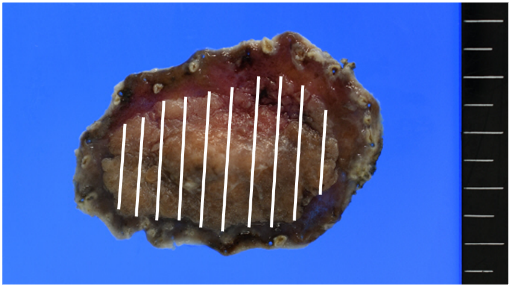
Early gastric cancer, 0-IIa+I, 45 x 29 mm,
tub2 > tub1, pT1a (M), ly0, v0, pHM0, pVM0, R0
早期大腸癌のESD
大腸腫瘍に対するESDの対象は、「リンパ節転移の可能性が極めて低く、病巣が内視鏡的一括切除できる大きさと部位であり、根治性が期待できる早期大腸癌あるいは癌が疑われる大きさ2㎝以上のポリープ」です。
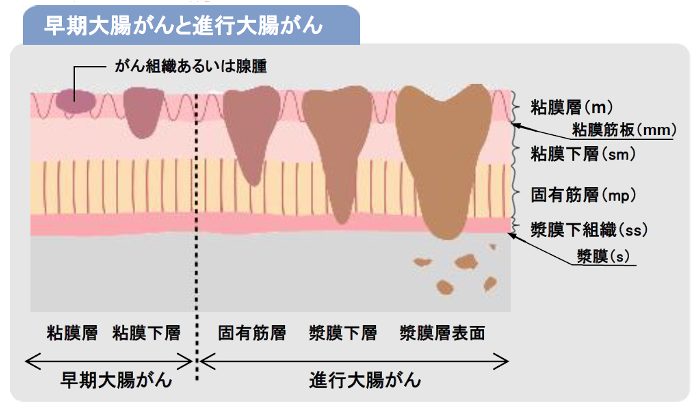
日本消化器内視鏡学会の治療ガイドラインでは、具体的に以下の病変がESDの適応となっています。

当院で施行した早期大腸癌ESD症例(治療時間 約60分、偶発症なし)
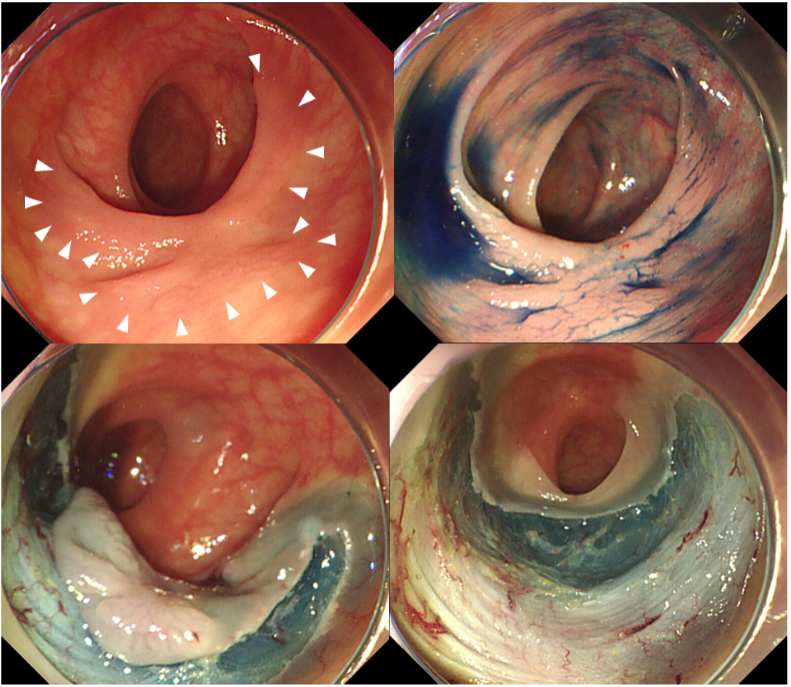
(左上:白い矢頭の範囲に腫瘍を認める。
右上:青い色素(インジゴカルミン)を散布すると、境界がより明瞭となる。
左下:ESDの過程、右下:切除後の状況)
病理結果)
Adenocarcinoma, tub1, 40 x 22 mm, pTis (M), ly0, v0, pHM0, pVM0, R0
当院消化器科勤務で取得可能な専門医の資格
当院では消化器病専門医・消化器内視鏡専門医取得が可能です。
スタッフ

副院長 消化器科 部長 福屋 裕嗣(ふくや ゆうじ)
- (H5年 筑波大学卒)
- 医学博士
- 日本内科学会 総合内科専門医
- 日本内科学会 内科指導医
- 日本消化器内視鏡学会 消化器内視鏡専門医
- 日本消化器内視鏡学会 消化器内視鏡指導医
- 日本消化器病学会 消化器病専門医
- 日本医師会 認定産業医

消化器科 医長 玄 泰行(げん やすゆき)
- (H14年 京都府立医科大学卒)
- 専門:消化器(消化器管・内視鏡)
- 医学博士
- 日本内科学会 認定内科医
- 日本内科学会 総合内科専門医
- 日本内科学会 内科指導医
- 日本消化器内視鏡学会 消化器内視鏡専門医
- 日本消化器内視鏡学会 消化器内視鏡指導医
- 日本消化器病学会 消化器病専門医
- 日本消化器病学会 消化器病指導医

医師 島田 憲(しまだ けん)
- 日本内科学会 内科専門医
診療・手術実績
上部消化管内視鏡検査
| 令和5年 | 令和6年 | 令和7年 |
|---|---|---|
| 2,310件 | 2,664件 | 2,731件 |
上部内視鏡的粘膜切除術(EMR)
| 令和5年 | 令和6年 | 令和7年 |
|---|---|---|
| 1件 | 4件 | 6件 |
上部内視鏡的粘膜下層剥離術(ESD)
| 令和5年 | 令和6年 | 令和7年 |
|---|---|---|
| 23件 | 30件 | 33件 |
上部内視鏡的止血術
| 令和5年 | 令和6年 | 令和7年 |
|---|---|---|
| 44件 | 57件 | 39件 |
内視鏡的食道静脈瘤結紮術(EVL)
| 令和5年 | 令和6年 | 令和7年 |
|---|---|---|
| 12件 | 5件 | 9件 |
内視鏡的胃瘻造設術(PEG)
| 令和5年 | 令和6年 | 令和7年 |
|---|---|---|
| 50件 | 44件 | 32件 |
下部消化管内視鏡検査
| 令和5年 | 令和6年 | 令和7年 |
|---|---|---|
| 1,089件 | 1,154件 | 1,258件 |
下部内視鏡的粘膜切除術(EMR)
| 令和5年 | 令和6年 | 令和7年 |
|---|---|---|
| 291件 | 302件 | 340件 |
下部内視鏡的粘膜下層剥離術(ESD)
| 令和5年 | 令和6年 | 令和7年 |
|---|---|---|
| 30件 | 27件 | 49件 |
下部内視鏡的止血術
| 令和5年 | 令和6年 | 令和7年 |
|---|---|---|
| 17件 | 21件 | 20件 |
内視鏡的逆行性胆管膵管造影検査(ERCP)
| 令和5年 | 令和6年 | 令和7年 |
|---|---|---|
| 317件 | 495件 | 560件 |
※内視鏡的胆道ドナレージ術(EBD)、内視鏡的砕石術・採石術(EML)、内視鏡的乳頭括約筋切開術(EST)、『胆道鏡・EHL』の件数を含む。
超音波内視鏡検査(EUS)
| 令和5年 | 令和6年 | 令和7年 |
|---|---|---|
| 17件 | 28件 | 38件 |
※超音波内視鏡ガイド下穿刺吸引生検法(EUS‐FNA)、超音波内視鏡下瘻孔形成術の件数を含む。


 救急診療はこちら
救急診療はこちら 048-736-1221
048-736-1221